La Química es parte de la Ciencia que estudia la obtención, las propiedades y la transformación de las Sustancias Puras y los sistemas que ellas forman.
La Ciencia es el conocimiento obtenido a través del llamado método científico.

Una
Sustancia Pura es un conjunto de moléculas idénticas, de igual tamaño, masa, y forma. Y las
moléculas la menor porción material en que se puede presentar una Sustancia Pura.
Las
moléculas estan en movimiento por lo tanto poseen energia cinética que es proporcional a la temperatura y además se atraen entre sí mediante fuerzas de atracción intermoleculares.
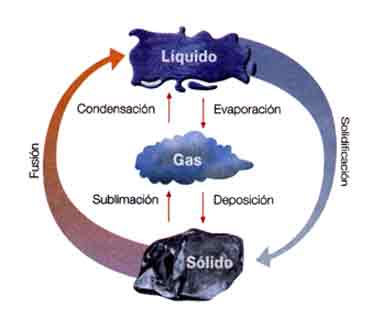
A los estados fisicos de la materia ya mencionados podemos agregar los estados de
cristal líquido y el estado de
plasma.fase: porcion material de idénticas propiedades físicas y químicas
Una Sustancia Pura puede ser una fase sólida o una fase líquida o una fase gaseosa dependiendo de la temperatura a la que se encuentre.
Clasificación de los sistemas materiales:
- Herterogéneos: 2 o más fases
- Homogéneos : 1 fase
TECNICAS DE SEPARACIÓN DE FASES DE SISTEMAS HETEROGENEOS:
- Filtración
- Decantación
- Centrifugación
- Sublimación
- Disolución
- Tamización
TECNICAS DE SEPARACIÓN DE SUSTANCIAS PURAS DESDE SISTEMAS HOMOGENEOS:
- Destilación
- Extracción por solvente
- Cristalización
- Cromatografía
SUSTANCIAS PURAS:
Cuando las Sustancias Puras reciben energia sus moleculas se modifican. En estos casos ha ocurrido un cambio quimico o reaccion quimica.
Sustancias de dificil ruptura o degradacion se consideran fundamentales y se les denomina Elementos y con ellas se formarian aquellas mas complejas y que se les denomina Compuestos.
Ley de la Conservacion de la Materia (Lavoisier):En un cambio quimico la masa de los reaccionantes es igual a la masa de los productos.
Ley de las Proporciones Definidas ( Proust): La proporcion en que los elementos se combinan para formar compuestos es definida o constante no importando la procedencia del compuesto.
Ley de las proporciones Mulltiples (Dalton): Los pesos de un elemento que se combinan con una cantidad fija de un segundo elemento cuando se forman dos o mas compuestos estan en relacion de numeros enteros.
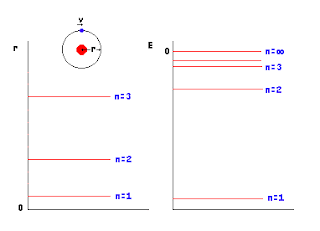
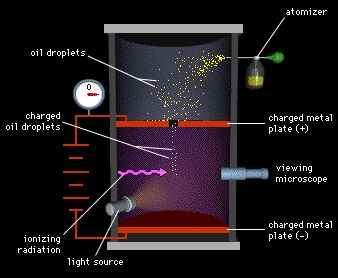
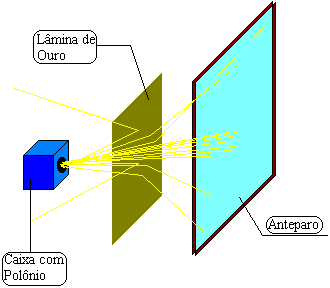
MODELO ATOMICO
Las moléculas estan formadas por particulas aun mas pequeñas, estas particulas se denominan atomos
- los atomos por medio los enlaces quimicos forman moleculas.
- los atomos de un mismo elemento son iguales.
- Un Cambio Quimico es un reordenamiento de atomos .

Analisis de Sustancias Puras:
El analisis de Sustancias Puras corresponde al denominado Analisis Quimico.
analisis quimico cualitativo: este comprende la separacion e identificacion de los elementos que forman un compuesto.
ana¡lisis quimico cuantitativo: este comprende la medicion de la cantidad de cada uno de los elementos que forman el compuesto.
NOMENCLATURA QUIMICA
- un atomo de un elemento se representa por un simbolo.
- una molecula de una Sustancia Pura se representa por su Formula.
Ley de volumenes de combinacion de gases(Gay(lussac): los volumenes de gases de Reaccionantes y Productos, medidos en iguales condiciones de Presion y Temperatura, estan en relacion de numeros enteros.
Principio de avogadro: en volumenes iguales, de cualquier gas, medidos en iguales condiciones de P y T existe igual numero de moleculas.