Diferentes experimentos demuestran la existencia de dos tipos de electricidad, se les denomina la positiva y la negativa. Si dos cuerpos poseen igual tipo de carga se repelen en tanto que si tienen cargas de distinto signo se atraen
.

- Surge la noción que la corriente eléctrica es un flujo de partículas que se les llamó electrones.
- Thompson demuestra experimentalmente, con el tubo de rayos catódicos la existencia de los electrones

Tubo de rayos catódicos
- Millikan determina la carga eléctrica del electrón en su clásico experimento de la gota de aceite.
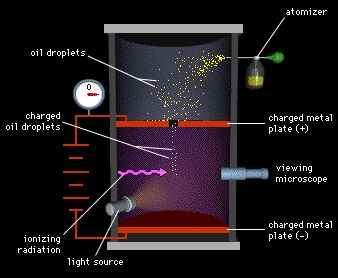
Así la carga del electrón se establece en 1,6 . 10 -19 coulomb y su masa en 9,1. 10 –28 gramos
Las particulas intratomicas fundamentales
Rutherford, bombardea una lámina de oro, con rayos alfa.
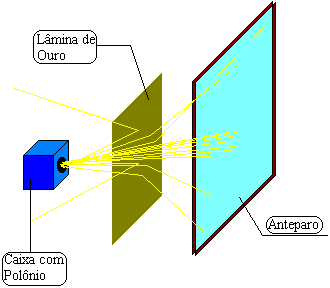
Se concluye la presencia en el núcleo del átomo, de los protones partículas cargadas positivamente. También se comprende la presencia en el nucleo de los neutrones sin carga eléctrica.
NOMENCLATURA PARA SISTEMAS ATOMICOS Y SUS MODIFICACIONES
NUMERO MÁSICO CARGA ELÉCTRICA O ESTADO DE OXIDACIÓN A CARGA
SÍMBOLO S
NÚMERO ATÓMICO ATOMICIDAD Z X
DEFINICIONES:
NÚMERO ATÓMICO = NÚMERO DE PROTONES = Z
NÚMERO MÁSICO = NÚMERO DE PROTONES + NÚMERO DE NEUTRONES = A
CARGA ELECTRICA = NÚMERO DE PROTONES - NÚMERO DE ELECTRONES
DETERMINACIÓN DE LOS PESOS ATOMICOS O PESOS RELATIVOS
No hay comentarios:
Publicar un comentario